- Entalpia i entropia w sprężaniu i rozprężaniu gazów technicznych
Entalpia a entropia – definicja, wzór, przykłady w pneumatyce
W przemyśle, a zwłaszcza w pneumatyce, sprężanie i rozprężanie gazów technicznych (m.in. powietrza, azotu, dwutlenku węgla, wodoru) stanowi fundament działania wielu instalacji technologicznych, od sprężarek i układów chłodniczych aż po procesy technologiczne wymagające kontrolowanej atmosfery. Aby w pełni zrozumieć zachowanie gazów podczas tych procesów, kluczowe są dwa wielkie pojęcia termodynamiki: entalpia i entropia.
Entalpia – energia przepływająca z gazem
Entalpia (H) to suma energii wewnętrznej gazu i pracy wykonanej przez gaz przy jego objętości przeciw ciśnieniu otoczenia. Jest miernikiem całkowitej energii związanej z gazem w układzie otwartym, w którym przepływa to medium.
Matematycznie:
H = U + p ⋅ V
gdzie:
H – entalpia [J],
U – energia wewnętrzna gazu [J],
p – ciśnienie [Pa],
V – objętość [m³].
Entalpia jest istotna w bilansach cieplnych urządzeń przemysłowych, np. sprężarek, wymienników ciepła czy zaworów rozprężnych.

Entropia – miara nieuporządkowania
Co to jest entropia?
Entropia (S) to pojęcie, które opisuje stopień nieuporządkowania cząsteczek w układzie. Im większa entropia, tym większy chaos w układzie. W kontekście przemysłowym entropia pozwala analizować, ile energii w procesie sprężania lub rozprężania jest nieodwracalnie tracone, czyli nie może być przekształcona w pracę użyteczną.
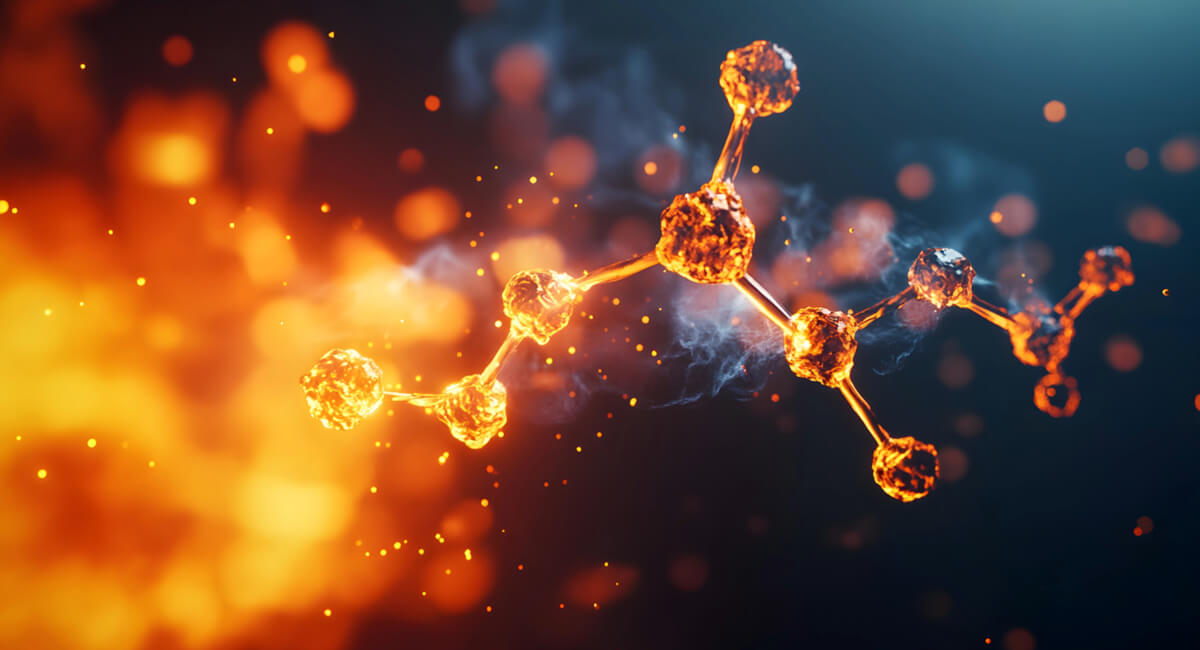
Dla gazów:
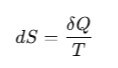
gdzie:
dS – zmiana entropii [J/K],
δQ – ciepło wymienione w sposób odwracalny [J],
T – temperatura [K].
Procesy sprężania gazów – analiza entalpii i entropii
Sprężanie adiabatyczne
W sprężaniu adiabatycznym nie następuje wymiana ciepła z otoczeniem. Cała praca wykonana w takim procesie podnosi temperaturę gazu i jego ciśnienie. Entropia w sprężaniu idealnie adiabatycznym pozostaje stała (proces izentropowy).
Zależność temperatury i ciśnienia w sprężaniu adiabatycznym:
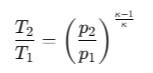
gdzie:
k – wykładnik adiabatyczny gazu (dla powietrza ≈ 1,4).
W praktyce jednak każde sprężanie ma straty — występują tarcie, opory przepływu, więc entropia rośnie.
Sprężanie izotermiczne
Przy sprężaniu izotermicznym temperatura gazu pozostaje stała (teoretycznie), ale wymaga to intensywnego odprowadzania ciepła. Entalpia pozostaje w dużej mierze bez zmian, ale rośnie ciśnienie i zmniejsza się objętość.
Energia potrzebna do sprężenia izotermicznego:
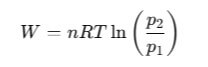
Proces izotermiczny jest energetycznie korzystniejszy niż adiabatyczny.
Rozprężanie gazów – entalpia a efekt Joule’a-Thomsona
Podczas rozprężania gazu bez wymiany ciepła z otoczeniem, gaz wykonuje pracę kosztem energii wewnętrznej. W praktyce często występuje efekt Joule’a-Thomsona: w rozprężaniu gazu bez wykonywania pracy zewnętrznej (np. w zaworze dławiącym) temperatura gazu maleje lub rośnie, w zależności od jego charakterystyki.
Entalpia w rozprężaniu bez wymiany ciepła (proces izentalpowy) pozostaje stała:
H1 = H2
W praktyce:
większość gazów w temperaturze pokojowej ochładza się podczas rozprężania (np. azot, powietrze),
niektóre gazy, jak wodór i hel, podgrzewają się przy rozprężaniu w temperaturze pokojowej.
Praktyczne znaczenie entalpii i entropii w pneumatyce i przemyśle
Energochłonność sprężania
Sprężanie powietrza jest kosztownym procesem. Straty energii wynikające z przyrostu entropii przekładają się na wyższe rachunki za prąd elektryczny w sprężarkowniach.
Dlatego stosuje się:
chłodnice międzystopniowe,
sprężarki wielostopniowe,
uzdatnianie sprężonego powietrza, by m.in. zmniejszyć opory przepływu.

Optymalizacja procesów rozprężania
Zawory rozprężne, dysze i elementy dławiące w pneumatyce (np. w instalacjach transportu pneumatycznego) projektuje się tak, by unikać zbyt dużych spadków temperatury, które mogą prowadzić do kondensacji pary wodnej i zatykania przewodów lodem.

Entalpia i entropia w obliczeniach przemysłowych
W inżynierii stosuje się tabele entalpii i entropii lub oprogramowanie (np. REFPROP, Aspen HYSYS), umożliwiające szybkie wyznaczanie parametrów gazów technicznych przy różnych ciśnieniach i temperaturach.
Przykładowe dane dla powietrza (przy 25°C i 1 bar):
entalpia: ok. 300 kJ/kg,
entropia: ok. 6,9 kJ/(kg·K).
Przykład zastosowania – kompresor powietrza
Załóżmy, że sprężamy powietrze z 1 bar do 7 barów w sposób adiabatyczny. Temperatura końcowa rośnie, co wymaga odprowadzenia ciepła, jeśli nie chcemy podgrzewać instalacji. Proces zwiększa entropię gazu, a więc powoduje dodatkowe straty energii.
Dlatego w praktyce stosuje się chłodzenie międzystopniowe – proces jest wtedy bliższy sprężaniu izotermicznemu, przy mniejszych stratach energii.

Wnioski i rekomendacje
Zrozumienie entalpii i entropii pozwala lepiej projektować instalacje pneumatyczne i procesowe. Analiza bilansu entalpii i entropii umożliwia zmniejszenie kosztów sprężania gazów technicznych. Warto stosować urządzenia do odzysku ciepła ze sprężarek, co ogranicza straty wynikające ze wzrostu entropii. W aplikacjach pneumatycznych (np. w robotyce, w układach transportu pneumatycznego) projektowanie zaworów i przewodów pod kątem rozprężania jest kluczowe dla uniknięcia problemów z zamarzaniem czy kondensacją.

Autor:
Krzysztof Kornacki
Product Manager
Pneumat.

Autor:
Krzysztof Kornacki
Product Manager
Pneumat.






Zapisz się do newslettera i zyskaj dostęp do największej pneumatycznej bazy wiedzy!
Zyskaj dostęp do najnowszych artykułów, informacji o nadchodzących targach, wydarzeniach i mobilnych szkoleniach oraz promocjach w naszym sklepie internetowym!




